Περιεχόμενο
Αν και όλα τα άτομα του ίδιου στοιχείου περιέχουν τον ίδιο αριθμό πρωτονίων, ο αριθμός των νετρονίων μπορεί να ποικίλει. Η γνώση πόσων νετρονίων έχει ένα συγκεκριμένο άτομο μπορεί να σας βοηθήσει να προσδιορίσετε εάν το σωματίδιο είναι κανονικό σε αυτό το στοιχείο ή ένα ισότοπο, το οποίο θα έχει περισσότερα ή λιγότερα νετρόνια. Ο προσδιορισμός του αριθμού των νετρονίων σε ένα άτομο είναι αρκετά απλός και δεν απαιτεί κανένα πείραμα. Για να υπολογίσετε τον αριθμό των νετρονίων σε ένα κανονικό άτομο ή ισότοπο, ακολουθήστε αυτές τις οδηγίες με έναν περιοδικό πίνακα στο χέρι.
Βήματα
Μέθοδος 1 από 2: Εύρεση του αριθμού των ουδέτερων σε ένα κοινό άτομο
Εντοπίστε το στοιχείο στον περιοδικό πίνακα. Για αυτό το παράδειγμα, ας δούμε το λειτουργικό σύστημα (Os), το οποίο βρίσκεται στην έκτη σειρά, από πάνω προς τα κάτω.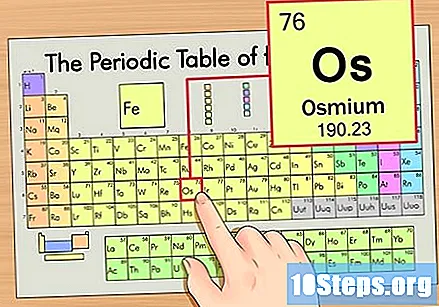
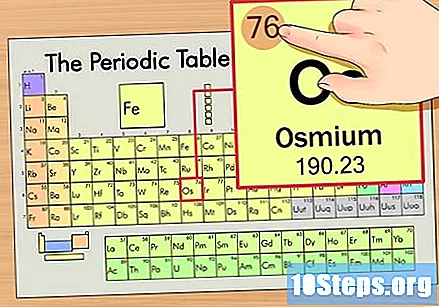
Βρείτε τον ατομικό αριθμό του στοιχείου. Αυτός είναι συνήθως ο πιο ορατός αριθμός για ένα συγκεκριμένο στοιχείο και είναι συνήθως πάνω από το σύμβολό του (στον πίνακα που χρησιμοποιούμε, στην πραγματικότητα, δεν υπάρχει άλλος αριθμός που αναφέρεται). Ο ατομικός αριθμός είναι ο αριθμός των πρωτονίων σε ένα μόνο άτομο αυτού του στοιχείου. Ο αριθμός Os είναι 76, πράγμα που σημαίνει ότι ένα άτομο Osmium έχει 76 πρωτόνια.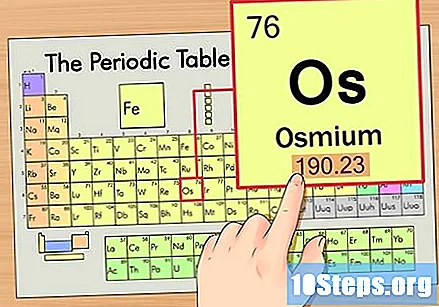
Βρείτε το ατομικό βάρος του στοιχείου. Αυτός ο αριθμός βρίσκεται συνήθως κάτω από το ατομικό σύμβολο. Σημειώστε ότι ο πίνακας σε αυτό το παράδειγμα βασίζεται μόνο στον ατομικό αριθμό και δεν παραθέτει το ατομικό βάρος. Αυτό δεν θα ισχύει πάντα. Το Όσμιο έχει ατομικό βάρος 190,23.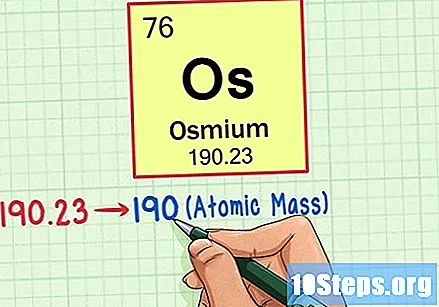
Στρογγυλοποιήστε το ατομικό βάρος στον πλησιέστερο ακέραιο αριθμό για να βρείτε την ατομική μάζα. Στο παράδειγμά μας, το 190,23 θα στρογγυλοποιηθεί στο 190, με αποτέλεσμα μια ατομική μάζα 190 για το Όσμιο.- Η ατομική μάζα είναι ένας μέσος όρος των ισοτόπων του στοιχείου. Επομένως, δεν είναι συνήθως ακέραιος.
Αφαιρέστε τον ατομικό αριθμό από την ατομική μάζα. Δεδομένου ότι η συντριπτική πλειονότητα της μάζας ενός ατόμου βρίσκεται στα πρωτόνια και στα ουδέτερα, αφαιρώντας τον αριθμό των πρωτονίων (δηλαδή τον ατομικό αριθμό) από την ατομική μάζα θα σας δοθεί ο αριθμός υπολογίστηκε νετρονίων στο άτομο. Ο αριθμός μετά το δεκαδικό σημείο αντιπροσωπεύει γενικά μια πολύ μικρή μάζα ηλεκτρονίων στο άτομο. Στο παράδειγμά μας, αυτό είναι: 190 (ατομική μάζα) - 76 (αριθμός πρωτονίων) = 114 (αριθμός νετρονίων).
Θυμηθείτε τον τύπο. Για να βρείτε τον αριθμό των νετρονίων στο μέλλον, απλώς χρησιμοποιήστε αυτόν τον τύπο: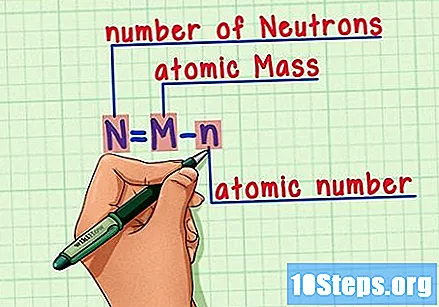
- Ν = Μ - ν.
- N = αριθμός Νευτρονίων.
- Μ = Ματομικό ψητό.
- η = νατομικό υγρό.
- Ν = Μ - ν.
Μέθοδος 2 από 2: Εύρεση του αριθμού των νετρονίων σε ένα ισότοπο
Εντοπίστε το στοιχείο στον περιοδικό πίνακα. Για παράδειγμα, ας χρησιμοποιήσουμε το ισότοπο άνθρακα-14. Επειδή η μη ισοτοπική μορφή του άνθρακα-14 είναι απλώς Άνθρακας (C), βρείτε αυτό το στοιχείο στον περιοδικό πίνακα (στη δεύτερη σειρά).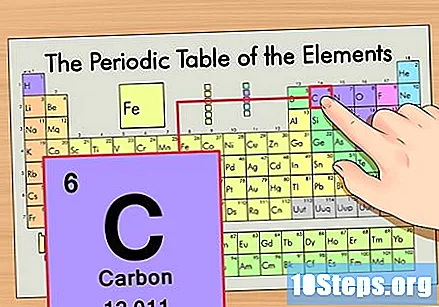
Βρείτε τον ατομικό αριθμό του στοιχείου. Αυτός είναι συνήθως ο πιο ορατός αριθμός για ένα συγκεκριμένο στοιχείο και είναι συνήθως πάνω από το σύμβολό του (στον πίνακα που χρησιμοποιούμε, στην πραγματικότητα, δεν υπάρχει άλλος αριθμός που αναφέρεται). Ο ατομικός αριθμός είναι ο αριθμός των πρωτονίων σε ένα μόνο άτομο αυτού του στοιχείου. Το C είναι ο αριθμός 6, που σημαίνει ότι ένα άτομο άνθρακα έχει 6 πρωτόνια.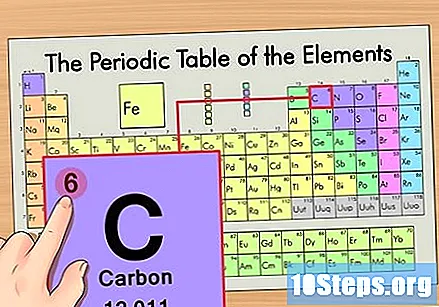
Βρείτε την ατομική μάζα. Αυτό είναι απίστευτα εύκολο με τα ισότοπα, καθώς ονομάζονται από την ατομική τους μάζα. Το Carbon-14 έχει ατομική μάζα 14. Μόλις βρείτε την ατομική μάζα του ισότοπου, η διαδικασία εύρεσης του αριθμού των νετρονίων είναι η ίδια με αυτή που χρησιμοποιείται για τα συνηθισμένα άτομα.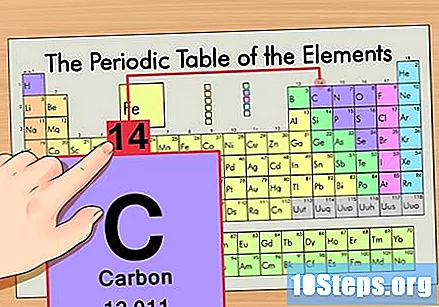
Αφαιρέστε τον ατομικό αριθμό από την ατομική μάζα. Δεδομένου ότι η συντριπτική πλειονότητα της μάζας ενός ατόμου βρίσκεται στα πρωτόνια και στα ουδέτερα, αφαιρώντας τον αριθμό των πρωτονίων (δηλαδή τον ατομικό αριθμό) από την ατομική μάζα θα σας δοθεί ο αριθμός υπολογίστηκε νετρονίων στο άτομο. Ο αριθμός μετά το δεκαδικό σημείο αντιπροσωπεύει γενικά μια πολύ μικρή μάζα ηλεκτρονίων στο άτομο. Στο παράδειγμά μας, αυτό είναι: 14 (ατομική μάζα) - 6 (αριθμός πρωτονίων) = 8 (αριθμός νετρονίων).
Θυμηθείτε τον τύπο. Για να βρείτε τον αριθμό των νετρονίων στο μέλλον, απλώς χρησιμοποιήστε αυτόν τον τύπο: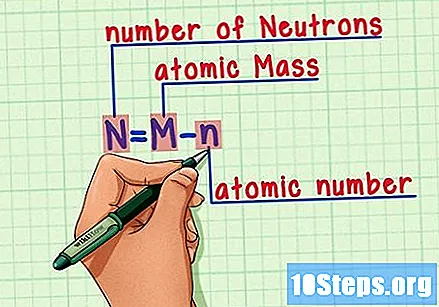
- Ν = Μ - ν.
- N = αριθμός Νευτρονίων.
- Μ = Ματομικό ψητό.
- η = νατομικό υγρό.
- Ν = Μ - ν.
Συμβουλές
- Το Osmium, ένα στερεό μέταλλο σε θερμοκρασία δωματίου, αντλεί το όνομά του από την ελληνική λέξη «μυρωδιά», «osme».
- Τα πρωτόνια και τα νετρόνια αποτελούν σχεδόν ολόκληρο το βάρος των στοιχείων, ενώ τα ηλεκτρόνια και άλλα διαφορετικά σωματίδια αντιπροσωπεύουν μια αμελητέα μάζα (πλησιάζει τη μηδενική μάζα). Δεδομένου ότι ένα πρωτόνιο έχει περίπου το ίδιο βάρος με ένα ουδέτερο και ο ατομικός αριθμός αντιπροσωπεύει τον αριθμό των πρωτονίων, μπορούμε απλά να αφαιρέσουμε τον αριθμό των πρωτονίων από τη συνολική μάζα.
- Εάν δεν είστε βέβαιοι ποιος αριθμός είναι στον περιοδικό πίνακα, απλώς θυμηθείτε ότι συνήθως γίνεται γύρω από τον ατομικό αριθμό (δηλαδή τον αριθμό των πρωτονίων), ο οποίος ξεκινά με 1 (υδρογόνο) και ανεβαίνει μία μονάδα ανά αριστερά προς τα δεξιά, που λήγει σε 118 (Ununóctio). Αυτό συμβαίνει επειδή ο αριθμός των πρωτονίων σε ένα άτομο καθορίζει ποιο είναι αυτό το άτομο, διευκολύνοντας την οργάνωση του στοιχειακού χαρακτηριστικού (για παράδειγμα, ένα άτομο με 2 πρωτόνια θα είναι πάντα Ήλιο, όπως και ένα άλλο άτομο με 79 πρωτόνια θα είναι πάντα Χρυσό).