Περιεχόμενο
Άλλες ενότητεςΤο υδρογόνο είναι το ελαφρύτερο στοιχείο και έχει πολλές βιομηχανικές χρήσεις, συμπεριλαμβανομένης της δημιουργίας υδρογονωμένων λιπών για χρήση στην κουζίνα και την παραγωγή υδρογονανθράκων από άνθρακα. Είναι ένα ουσιαστικό μέρος των μορίων του νερού και μπορεί να διαχωριστεί χρησιμοποιώντας μια μικρή ποσότητα ηλεκτρικής ενέργειας. Μπορείτε επίσης να παράγετε αέριο υδρογόνο χρησιμοποιώντας μερικά ενεργά μέταλλα και ισχυρά οξέα. Και οι δύο μέθοδοι είναι σχετικά απλές και θα σας επιτρέψουν να συλλέξετε αέριο υδρογόνο.
Βήματα
Μέθοδος 1 από 2: Χρήση μετατόπισης νερού με ενεργά μέταλλα
Συγκεντρώστε τα απαραίτητα υλικά. Για να συλλέξετε υδρογόνο χρησιμοποιώντας την αντίδραση ανάμιξης ενός ισχυρού οξέος με ένα ενεργό μέταλλο, θα χρειαστείτε: μια φιάλη Erlenmeyer, ένα ελαστικό πώμα, πλαστική σωλήνωση, αποσταγμένο νερό, δοκιμαστικούς σωλήνες, ένα μεγάλο δοχείο, 3 γραμμομοριακό υδροχλωρικό οξύ (HCl) και σφαιρίδια μαγνησίου ή ψευδαργύρου.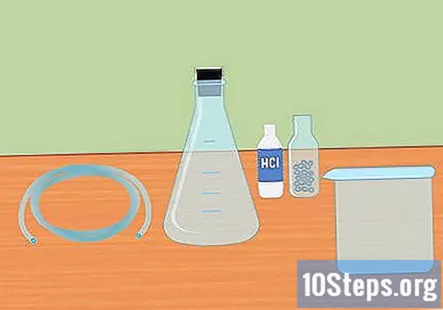
- Η φιάλη Erlenmeyer είναι μια γυάλινη φιάλη που έχει κωνικό πυθμένα και κυλινδρικό λαιμό.
- Το ελαστικό πώμα είναι για την κορυφή της φιάλης και πρέπει να έχει μια τρύπα στη μέση για να περάσει η σωλήνωση.
- Είτε το μαγνήσιο είτε ο ψευδάργυρος θα λειτουργήσουν για αυτό το πείραμα, δεν χρειάζεστε και τα δύο.
- Ορισμένες από αυτές τις προμήθειες μπορεί να χρειαστεί να αγοραστούν στο διαδίκτυο ή σε εργαστήριο προμηθειών.

Φορέστε κατάλληλο προστατευτικό εξοπλισμό. Όταν εργάζεστε με ένα ισχυρό οξύ όπως το υδροχλωρικό οξύ, θέλετε να βεβαιωθείτε ότι έχετε λάβει τις κατάλληλες προφυλάξεις ασφαλείας. Είναι απαραίτητο να φοράτε παλτό εργαστηρίου, γάντια, παπούτσια με κλειστά δάχτυλα και προστασία των ματιών.- Τα γυαλιά πρέπει να τυλίγονται γύρω από τις πλευρές των ματιών σας για να τα προστατεύουν από πιτσιλιές.
- Φοράτε γάντια που ταιριάζουν σωστά, ώστε να διατηρείτε καλή επιδεξιότητα στα χέρια και τα δάχτυλά σας.
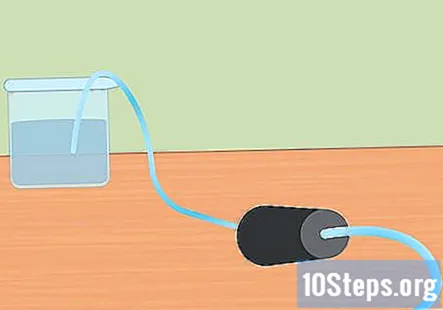
Προετοιμάστε την πειραματική ρύθμιση. Εισάγετε το ένα άκρο του σωλήνα στην οπή του ελαστικού πώματος. Θέλετε η σωλήνωση να περάσει μέχρι το ελαστικό πώμα και να κολλήσει ελαφρώς από το τέλος. Γεμίστε το μεγάλο δοχείο με νερό και τοποθετήστε το ελεύθερο άκρο του σωλήνα στο νερό. Όταν ξεκινήσει το πείραμα, θα τοποθετήσετε το ελαστικό πώμα στη φιάλη Erlenmeyer.- Αφήστε τα κομμάτια στην άκρη μέχρι να είστε έτοιμοι να τα χρησιμοποιήσετε.
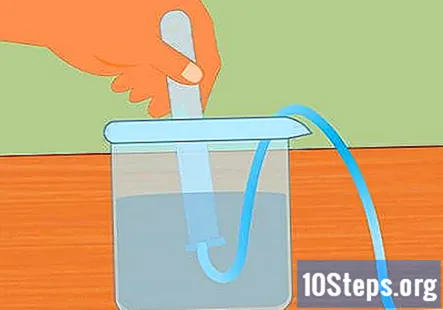
Βυθίστε το δοκιμαστικό σωλήνα στο νερό. Πάρτε τουλάχιστον έναν δοκιμαστικό σωλήνα (μπορείτε να χρησιμοποιήσετε περισσότερο εάν θέλετε να συλλέξετε περισσότερο υδρογόνο) και να τον βυθίσετε στο νερό. Γείρετε το σωλήνα έτσι ώστε να διαφύγουν όλες οι φυσαλίδες αέρα. Τοποθετήστε το σωλήνα πάνω από τον βυθισμένο σωλήνα που είναι προσαρτημένος στο ελαστικό πώμα στο αντίθετο άκρο.- Είναι σημαντικό να αφαιρέσετε όλες τις φυσαλίδες αέρα από το σωλήνα πριν ξεκινήσετε. Εάν δεν είναι, το αέριο που συλλέγεται στον σωλήνα θα είναι κάτι περισσότερο από υδρογόνο.
Προσθέστε υδροχλωρικό οξύ στη φιάλη Erlenmeyer. Προσθέστε αρκετό υδροχλωρικό οξύ για να γεμίσετε τη φιάλη περίπου στα μισά. Περίπου 100 mL θα πρέπει να είναι επαρκή. Βεβαιωθείτε ότι η φιάλη είναι καθαρή και στεγνή πριν προσθέσετε το οξύ. Φοράτε λαστιχένια γάντια και προσέξτε όταν γεμίζετε τη φιάλη.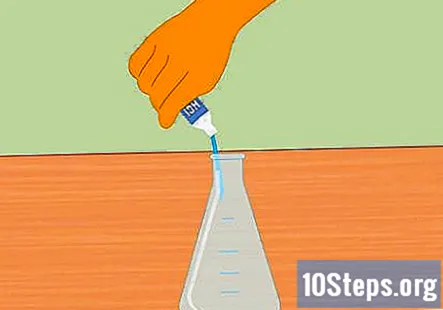
- Προσέξτε να μην χύσετε νερό στο οξύ. Το νερό που προστίθεται στο οξύ μπορεί να οδηγήσει σε έκρηξη και τραυματισμό.
Ξεκινήστε τη χημική αντίδραση προσθέτοντας μεταλλικά σφαιρίδια στο HCl. Προσθέστε μια χούφτα σφαιρίδια ψευδαργύρου ή μαγνησίου στο υδροχλωρικό οξύ στη φιάλη. Το ακριβές ποσό που βάζετε δεν είναι σημαντικό, αλλά μια μικρή χούφτα πρέπει να είναι αρκετή για να ξεκινήσει η αντίδραση.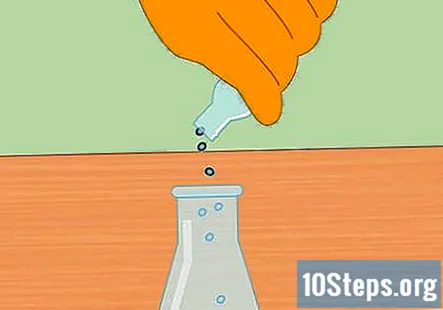
- Αφού προσθέσετε τα σφαιρίδια, τοποθετήστε το πώμα στη φιάλη έτσι ώστε το σύστημα να είναι τώρα κλειστό.
Συλλέξτε το υδρογόνο σε έναν βυθισμένο δοκιμαστικό σωλήνα. Καθώς το μέταλλο αντιδρά με το οξύ, παράγεται αέριο υδρογόνο. Αυτό το υδρογόνο ταξιδεύει στην κορυφή της φιάλης, μέσω του σωλήνα και στον δοκιμαστικό σωλήνα βυθισμένο στο νερό. Το αέριο θα αντικαταστήσει το νερό και θα πρέπει να δείτε μια μορφή φυσαλίδας στο πάνω μέρος του δοκιμαστικού σωλήνα.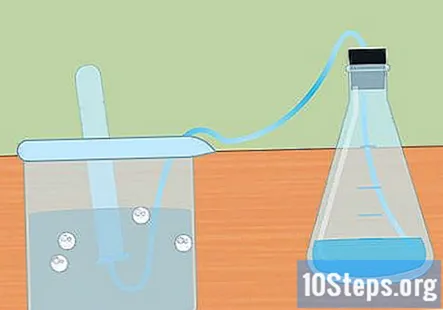
- Όταν ο δοκιμαστικός σωλήνας γεμίζει με υδρογόνο, βυθίστε έναν άλλο σωλήνα με νερό και τοποθετήστε τον πάνω από τη σωλήνωση. Μπορείτε να συλλέξετε τόσο πολύ υδρογόνο όσο παράγεται από την αντίδρασή σας.
- Κρατήστε τους δοκιμαστικούς σωλήνες στραμμένους προς τα κάτω για να αποτρέψετε τη διαφυγή του αερίου υδρογόνου στον αέρα.
Επιβεβαιώστε ότι το αέριο είναι υδρογόνο. Για να επιβεβαιώσετε ότι το αέριο είναι υδρογόνο, μπορείτε να κάνετε αυτό που ονομάζεται δοκιμή νάρθηκα. Ανάψτε ένα σπίρτο και κρατήστε το κάτω από το σωλήνα. Θα ακούσετε έναν ήχο "ποπ" ή τσίμπημα, που δείχνει ότι υπάρχει υδρογόνο.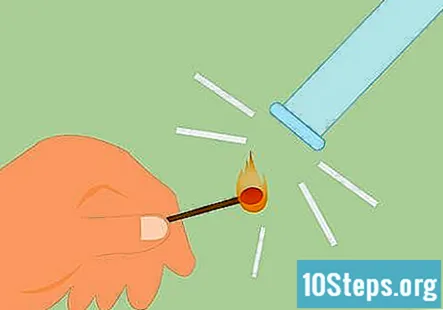
Μέθοδος 2 από 2: Χρήση ηλεκτρόλυσης
Συγκεντρώστε τα απαραίτητα υλικά. Σε αυτό το πείραμα, θα χρησιμοποιήσετε ηλεκτρική ενέργεια για να διαχωρίσετε τα αέρια υδρογόνου και οξυγόνου από μόρια νερού. Για να συλλέξετε αέριο υδρογόνο χρησιμοποιώντας ηλεκτρόλυση, θα χρειαστείτε μια μπαταρία 9 volt, ένα μολύβι, δύο δοκιμαστικούς σωλήνες, ένα πλαστικό δοχείο, νερό, μαγειρική σόδα, δύο μεγάλες λαστιχένιες ταινίες (προαιρετικά) και ένα κλιπ μπαταρίας με σφιγκτήρες στο τέλος.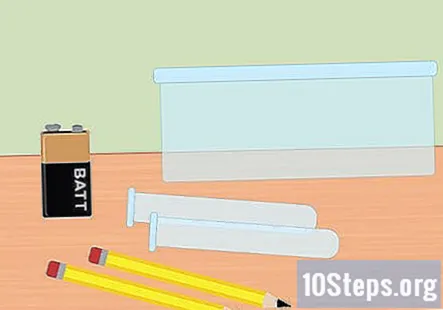
- Το μολύβι πρέπει να έχει γραφίτη για να λειτουργήσει αυτό. Ένα νούμερο 2 μολύβι είναι τέλειο. Δύο μικρά κομμάτια γραφίτη θα λειτουργήσουν επίσης για αυτό.
- Αρκεί ένα μικρό δοχείο αποθήκευσης τροφίμων ή ένα μπολ.
- Βεβαιωθείτε ότι το κλιπ μπαταρίας μπορεί να χωρέσει μια μπαταρία 9 volt και ότι έχει ένα κόκκινο και μαύρο καλώδιο με αλλιγάτορες σφιγκτήρες στο τέλος. Αυτοί οι σφιγκτήρες θα χρησιμοποιηθούν για να συνδέσετε το σύστημά σας με την μπαταρία.
Αφαιρέστε τη γόμα από το μολύβι και σπάστε το μολύβι στο μισό. Χρειάζεστε δύο κομμάτια γραφίτη, ένα για το θετικό άκρο της μπαταρίας και για το αρνητικό άκρο της μπαταρίας. Ακονίστε και τα δύο άκρα κάθε κομματιού του μολυβιού σε ένα σημείο. Βεβαιωθείτε ότι ο γραφίτης είναι καλά εκτεθειμένος.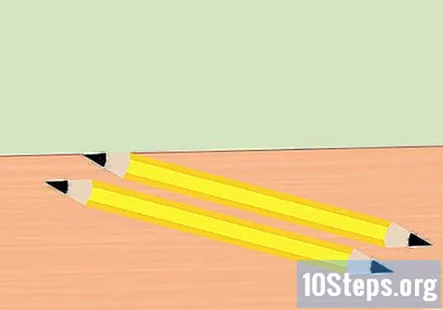
- Αυτό το βήμα μπορεί να παραλειφθεί εάν έχετε ήδη δύο κομμάτια καθαρού γραφίτη.
Τυλίξτε 2 λαστιχένιες ταινίες γύρω από το δοχείο σε σχήμα Χ. Αυτό το βήμα είναι προαιρετικό, αλλά είναι ένας εύκολος τρόπος για να διατηρήσετε τους δοκιμαστικούς σωλήνες στη θέση τους κατά τη διάρκεια του πειράματος. Τεντώστε μια λαστιχένια ταινία πάνω από το δοχείο και τεντώστε μια δεύτερη λαστιχένια ταινία πάνω του έτσι ώστε να διασχίσει την πρώτη, σχηματίζοντας ένα Χ.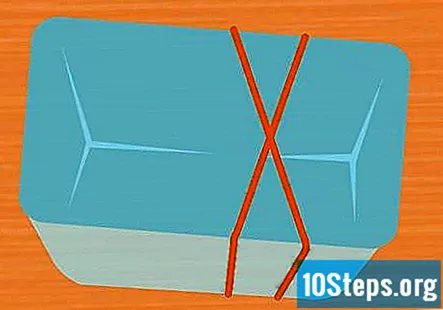
- Εάν δεν χρησιμοποιείτε λαστιχένιες ταινίες, φροντίστε να ασφαλίσετε τους δοκιμαστικούς σωλήνες με ταινία ή κορδόνι έτσι ώστε να παραμένουν ανάποδα κατά τη διάρκεια του πειράματος.
Φτιάξτε ένα διάλυμα μαγειρικής σόδας και νερού. Η διάλυση της μαγειρικής σόδας στο νερό θα βοηθήσει την ηλεκτρική ενέργεια να διοχετεύεται στο σύστημα. Η ακριβής ποσότητα της προστιθέμενης σόδας δεν είναι σημαντική, αλλά περίπου 1 κουταλάκι του γλυκού ανά 1 φλιτζάνι νερό θα πρέπει να είναι αρκετή. Ανακατέψτε μέχρι να διαλυθεί πλήρως.
- Χρησιμοποιήστε ζεστό νερό για να επιταχύνετε τη διάλυση της μαγειρικής σόδας.
Γεμίστε το πλαστικό δοχείο και τους δοκιμαστικούς σωλήνες με το διάλυμα μαγειρικής σόδας. Το δοχείο πρέπει να είναι αρκετά μεγάλο για να συγκρατεί και τους δύο δοκιμαστικούς σωλήνες. Προσθέστε αρκετή λύση για να γεμίσετε το δοχείο περίπου τρία τέταρτα. Βυθίστε τους δοκιμαστικούς σωλήνες στο διάλυμα του δοχείου και γυρίστε τους ανάποδα. Τοποθετήστε κάθε σωλήνα στο σταυρό της λαστιχένιας ταινίας X για να τον κρατήσετε στη θέση του.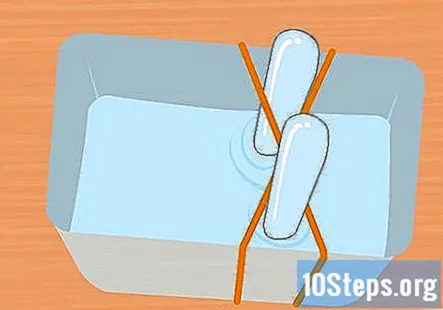
- Είναι πολύ σημαντικό και οι δύο δοκιμαστικοί σωλήνες να είναι εντελώς γεμάτοι νερό και να μην παραμένουν φυσαλίδες αέρα.
Συνδέστε τους αλλιγάτορες σφιγκτήρες στον γραφίτη. Βγάλτε έναν σφιγκτήρα από το κλιπ μπαταρίας και στερεώστε τον στο τέλος ενός από τα μολύβια. Βεβαιωθείτε ότι αγγίζει όσο το δυνατόν περισσότερο τον γραφίτη. Κάντε το ίδιο με τον υπόλοιπο αλιγάτορα σφιγκτήρα και το μολύβι.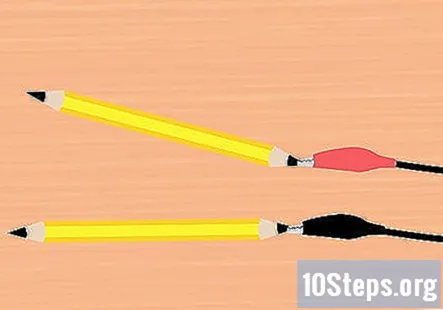
- Ένα μολύβι πρέπει να είναι προσαρτημένο στον κόκκινο σφιγκτήρα και ένα μολύβι στον μαύρο σφιγκτήρα.
Σύρετε το άσχημο άκρο του μολυβιού στο δοκιμαστικό σωλήνα. Διατηρώντας τον δοκιμαστικό σωλήνα εντελώς βυθισμένο, γείρετε ελαφρά έτσι ώστε να μπορείτε να σύρετε το άκρο του μολυβιού χωρίς σφράγιση στον σωλήνα. Επαναλάβετε αυτήν τη διαδικασία με το άλλο μολύβι και τον άλλο δοκιμαστικό σωλήνα.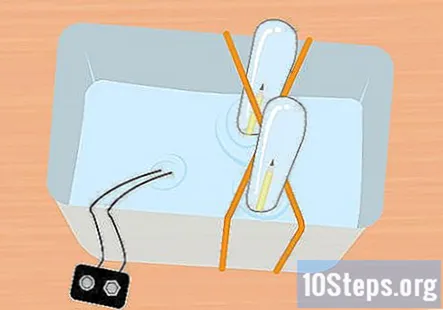
- Σε αυτό το σημείο, όλα πρέπει να είναι υποβρύχια και πρέπει να υπάρχει ένα κομμάτι μολύβι μέσα σε κάθε δοκιμαστικό σωλήνα.
- Κρατήστε το άκρο του κλιπ μπαταρίας που συνδέεται με την μπαταρία έξω από το νερό.
Συνδέστε το κλιπ μπαταρίας στην μπαταρία 9 volt. Με τα πάντα ρυθμισμένα, είστε πλέον έτοιμοι να εφαρμόσετε την ηλεκτρική ενέργεια που παρέχεται από την μπαταρία 9 volt. Το άκρο του κλιπ μπαταρίας πρέπει να βγαίνει έξω από το δοχείο, οπότε απλώς κόψτε τη μπαταρία στη θέση της. Μόλις συνδεθεί η μπαταρία, θα πρέπει να παρατηρήσετε ότι οι φυσαλίδες ανεβαίνουν από το άκρο του γραφίτη και κυμαίνονται στην κορυφή κάθε δοκιμαστικού σωλήνα.
- Εάν δεν εμφανίζονται φυσαλίδες, ελέγξτε για να βεβαιωθείτε ότι οι σφιγκτήρες αλιγάτορα είναι σταθερά συνδεδεμένοι στον γραφίτη του μολυβιού. Επίσης, βεβαιωθείτε ότι η μπαταρία σας είναι πλήρως φορτισμένη.
- Ο δοκιμαστικός σωλήνας με το αρνητικό σύρμα συνδεδεμένο στο μολύβι θα παράγει υδρογόνο, ενώ ο δοκιμαστικός σωλήνας που είναι συνδεδεμένος στο θετικό καλώδιο της μπαταρίας θα παράγει οξυγόνο.
Συλλέξτε υδρογόνο και οξυγόνο στους δύο δοκιμαστικούς σωλήνες έως ότου έχετε λίγες ίντσες αερίου σε κάθε σωλήνα. Θυμηθείτε, ο σωλήνας που είναι συνδεδεμένος στο αρνητικό άκρο της μπαταρίας θα έχει το υδρογόνο και το οξυγόνο θα είναι στον σωλήνα συνδεδεμένο με το θετικό άκρο. Αφαιρέστε τους δοκιμαστικούς σωλήνες από το βάζο, έναν κάθε φορά. Κρατήστε τα ανάποδα και αφήστε το νερό να στραγγίσει. Το αέριο στους σωλήνες θα παραμείνει παρόλο που δεν μπορείτε να το δείτε.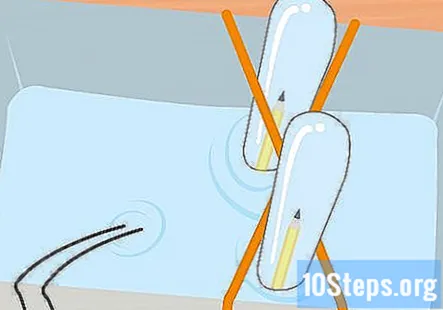
Δοκιμή για την παρουσία υδρογόνου. Μπορείτε να ελέγξετε για την παρουσία υδρογόνου χτυπώντας έναν αγώνα και κρατώντας τη φλόγα μέχρι το αέριο. Θα κάνει έναν πολύ διακριτό ήχο "squeaky pop" εάν είναι υδρογόνο. Μπορείτε επίσης να χρησιμοποιήσετε ένα αναμμένο κερί αντί για αγώνα.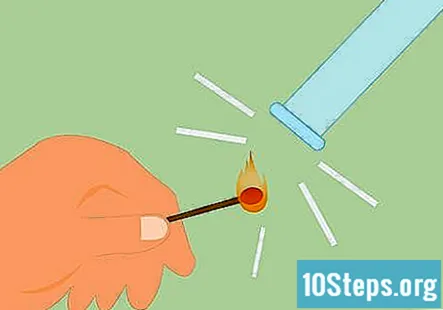
- Για να ελέγξετε για οξυγόνο στο δοκιμαστικό σωλήνα που ήταν συνδεδεμένος με τη θετική πλευρά της πηγής ισχύος, εκτοξεύστε ένα αναμμένο σπίρτο (ή κερί) και τοποθετήστε το ακτινοβόλο άκρο κάτω από το δοκιμαστικό σωλήνα. Εάν το κερί επανέλθει, υπάρχει οξυγόνο.
Ερωτήσεις και απαντήσεις κοινότητας
Χρειάζομαι δύο δοκιμαστικούς σωλήνες εάν θέλω να συλλέγω μόνο υδρογόνο;

Ο περιβαλλοντικός επιστήμονας Bess Ruff είναι διδακτορικός φοιτητής Γεωγραφίας στο Πανεπιστήμιο της Φλόριντα. Έλαβε το μεταπτυχιακό της στην Επιστήμη και τη Διαχείριση Περιβάλλοντος από το Πανεπιστήμιο της Καλιφόρνια, στη Σάντα Μπάρμπαρα το 2016. Έχει πραγματοποιήσει έρευνα για έργα θαλάσσιου χωροταξικού σχεδιασμού στην Καραϊβική και παρείχε ερευνητική υποστήριξη ως μεταπτυχιακός συνεργάτης για την Ομάδα Αειφόρου Αλιείας.

Πόσο υδρογόνο μπορεί να συλλεχθεί από αυτό το απλό πείραμα της ηλεκτρόλυσης; Και ποια θα ήταν η πίεση του αερίου υδρογόνου;
Αυτο εξαρταται. Ο ρυθμός της αντίδρασης (διαίρεση νερού) βασίζεται στους ενισχυτές της μπαταρίας και στον χρόνο που απομένει για να αντιδράσει. Συνήθως, το υδρογόνο θα ήταν περίπου στην πίεση της στάθμης της θάλασσας, εκτός εάν κάνετε το πείραμα σε ένα πολύ ζεστό ή κρύο περιβάλλον.
Γιατί το υδρογόνο συλλέγεται στον αρνητικό σωλήνα
Λόγω του τρόπου με τον οποίο τα μόρια νερού μοιράζονται ηλεκτρόνια, τα άτομα υδρογόνου φορτίζονται θετικά και τα άτομα οξυγόνου φορτίζονται αρνητικά. Κατά την εξαγωγή των αερίων, το θετικά φορτισμένο υδρογόνο θα προσελκύεται στον αρνητικό σωλήνα, ενώ το αρνητικά φορτισμένο οξυγόνο θα προσελκύεται στον θετικό σωλήνα.
Γιατί το αέριο δεν διαφύγει από το σωλήνα συλλογής αερίου μου;
Είναι υδρογόνο, ένα αέριο που είναι ελαφρύτερο από όλα τα άλλα, συμπεριλαμβανομένου του ηλίου, που σημαίνει ότι θα παραμείνει στον δοκιμαστικό σωλήνα όσο το κλειστό άκρο του σωλήνα είναι στην κορυφή, επειδή τα άλλα αέρια το αντικαθιστούν. Ο λόγος που χρησιμοποιούμε ήλιο αντί υδρογόνου είναι ότι δεν είναι εύφλεκτο. Αυτό οφείλεται στο γεγονός ότι είναι ένα ευγενές αέριο (έχει ένα πλήρες κέλυφος σθένους 8 ηλεκτρονίων) και επομένως είναι μη αντιδραστικό.
Το αέριο θα ήταν πολύ εύφλεκτο;
Ναί. Δείτε την καταστροφή του Hindenburg στο YouTube. Οι zeppelins χρησιμοποίησαν υδρογόνο λόγω του ότι είναι το ελαφρύτερο αέριο και αρκετά εύκολο να ληφθούν. Γι 'αυτό και ορισμένοι κατασκευαστές αυτοκινήτων εργάζονται σε αυτοκίνητα με υδρογόνο.
είναι αυτή η υγρή μορφή υδρογόνου;
Όχι - το υδρογόνο σε αυτό το πείραμα θα είναι αέριο
Πώς μπορώ να υγροποιήσω το υδρογόνο; Απάντηση
Προειδοποιήσεις
- Προσέξτε με καθαρό υδρογόνο. Είναι εξαιρετικά εκρηκτικό όταν αναμιγνύεται με αέρα.
- Βεβαιωθείτε ότι έχει αφαιρεθεί όλος ο άλλος αέρας από τον εξοπλισμό στον οποίο συλλέγετε υδρογόνο.