Περιεχόμενο
Η εκατοστιαία μάζα καθορίζει το ποσοστό κάθε στοιχείου που σχηματίζει μια χημική ένωση. Για να βρείτε αυτήν την τιμή, θα χρειαστείτε τη μοριακή μάζα των σύνθετων στοιχείων σε γραμμάρια / γραμμομόρια ή τον αριθμό γραμμαρίων που χρησιμοποιήθηκαν για τη δημιουργία του διαλύματος. Η εκατοστιαία μάζα μπορεί να υπολογιστεί με απλό τρόπο χρησιμοποιώντας έναν βασικό τύπο που διαιρεί τη μάζα του στοιχείου (ή της διαλυμένης ουσίας) με τη μάζα της ένωσης (ή του διαλύματος).
Βήματα
Μέθοδος 1 από 2: Εύρεση του ποσοστού μάζας με δεδομένες μάζες
- Ορίστε την εξίσωση για το ποσοστό μάζας μιας ένωσης. Ο βασικός τύπος για μια ένωση είναι: εκατοστιαία μάζα = () x 100. Πρέπει να πολλαπλασιάσετε το αποτέλεσμα με 100 στο τέλος για να εκφράσετε τις τιμές ως ποσοστά.
- Η μάζα μιας χημικής ένωσης στην οποία σας ενδιαφέρει είναι η μάζα που δίνεται στο πρόβλημα. Εάν αυτή η τιμή δεν παρέχεται, ανατρέξτε στην ακόλουθη μέθοδο και μάθετε πώς να βρείτε το ποσοστό μάζας όταν δεν δίνεται η μάζα.
- Η συνολική μάζα μιας ένωσης υπολογίζεται προσθέτοντας τις μάζες όλων των στοιχείων που χρησιμοποιούνται για τη δημιουργία της ένωσης ή του διαλύματος.
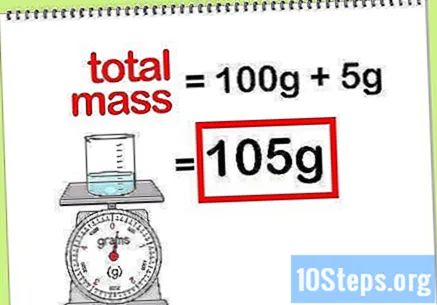
Υπολογίστε τη συνολική μάζα της ένωσης. Όταν γνωρίζετε την τιμή μάζας όλων των στοιχείων ή ενώσεων που προστίθενται, απλά πρέπει να τα προσθέσετε για να υπολογίσετε τη μάζα της ένωσης ή της τελικής λύσης. Αυτή η τιμή θα είναι ο παρονομαστής στον υπολογισμό της εκατοστιαίας μάζας.- Για παράδειγμα: Ποια είναι η εκατοστιαία μάζα 5 g υδροξειδίου του νατρίου που διαλύεται σε 100 g νερού;
- Η συνολική μάζα της ένωσης είναι η ποσότητα υπεροξειδίου του νατρίου συν η ποσότητα νερού: 100 g + 5 g, συνολικής μάζας 105 g.

Προσδιορίστε τη μάζα της εν λόγω χημικής ουσίας. Όταν πρέπει να βρείτε το ποσοστιαία μάζα, το πρόβλημα θέλει να βρείτε τη μάζα ενός συγκεκριμένου στοιχείου (το εν λόγω στοιχείο) ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Σημειώστε τη μάζα του εν λόγω στοιχείου. Αυτή η τιμή θα είναι ο αριθμητής στον υπολογισμό της εκατοστιαίας μάζας.- Για παράδειγμα, η μάζα του στοιχείου είναι 5 g υδροξειδίου του νατρίου.
- Αντικαταστήστε τις μεταβλητές στον τύπο μάζας ποσοστού. Αφού προσδιορίσετε τις τιμές για κάθε μεταβλητή, αντικαταστήστε τις στην εξίσωση.
- Για παράδειγμα: ποσοστό μάζας = () x 100 = () x 100.

Υπολογίστε το ποσοστό μάζας. Τώρα που έχει σχηματιστεί η εξίσωση, απλώς λύστε την για να υπολογίσετε το ποσοστό μάζας. Διαιρέστε τη μάζα του στοιχείου με τη συνολική μάζα της ένωσης και πολλαπλασιάστε επί 100. Το αποτέλεσμα θα είναι η εκατοστιαία μάζα του χημικού στοιχείου.- Για παράδειγμα: () x 100 = 0,04761 x 100 = 4,751%. Έτσι, η εκατοστιαία μάζα 5 g υδροξειδίου του νατρίου διαλυμένου σε 100 g νερού είναι 4,751%.
Μέθοδος 2 από 2: Εύρεση του ποσοστού μάζας με τις μάζες που δεν δίνονται
- Ορίστε την εξίσωση για το ποσοστό μάζας μιας ένωσης. Ο βασικός τύπος για το ποσοστό μάζας μιας ένωσης είναι: εκατοστιαία μάζα = () x 100. Πρέπει να πολλαπλασιάσετε το αποτέλεσμα με 100 στο τέλος για να εκφράσετε τις τιμές ως ποσοστά.
- Όταν δεν γνωρίζετε τις τιμές μάζας, μπορείτε να βρείτε το ποσοστό μάζας ενός στοιχείου της ένωσης χρησιμοποιώντας τη μοριακή μάζα.
- Για παράδειγμα: Ποια είναι η εκατοστιαία μάζα υδρογόνου σε ένα μόριο νερού;.
Γράψε το χημική φόρμουλα. Εάν δεν παρέχονται οι χημικοί τύποι για κάθε ένωση, θα πρέπει να τους γράψετε. Διαφορετικά, μεταβείτε στο βήμα "Εύρεση της μάζας κάθε στοιχείου".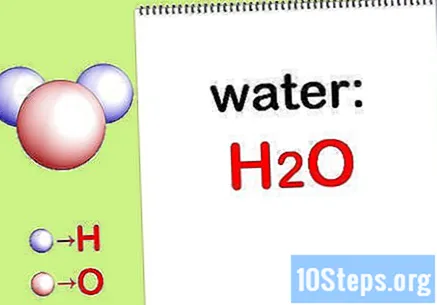
- Για παράδειγμα, γράψτε τον χημικό τύπο για το νερό: H2Ο.
Βρείτε τη μάζα κάθε στοιχείου στην ένωση. Αναζητήστε το μοριακό βάρος κάθε στοιχείου των χημικών τύπων με αναφορά στον περιοδικό πίνακα. Γενικά, η μάζα ενός στοιχείου βρίσκεται κάτω από το σύμβολο του χημικού στοιχείου. Σημειώστε τις μάζες κάθε στοιχείου της ένωσης.
- Για παράδειγμα, η μοριακή μάζα οξυγόνου είναι 15,9994, και αυτή του υδρογόνου είναι 1,0079.
Πολλαπλασιάστε τις μάζες με τη γραμμομοριακή αναλογία. Προσδιορίστε πόσα γραμμομόρια κάθε στοιχείου είναι στη χημική ένωση. Ο αριθμός γραμμομορίων δίδεται από τον εγγεγραμμένο αριθμό της ένωσης. Πολλαπλασιάστε τη μοριακή μάζα κάθε στοιχείου με τη μοριακή αναλογία.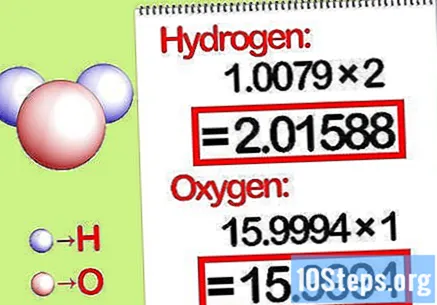
- Για παράδειγμα, η γραμμομοριακή αναλογία υδρογόνου προς οξυγόνο σε νερό είναι 2: 1. Επομένως, πολλαπλασιάστε το μοριακό βάρος του υδρογόνου με δύο (1.00794 Χ 2 = 2.01588) και αφήστε το μοριακό βάρος του οξυγόνου ως έχει (15.9994).
Υπολογίστε τη συνολική μάζα της ένωσης. Προσθέστε τη συνολική μάζα όλων των στοιχείων της ένωσης. Χρησιμοποιώντας τις μάζες που υπολογίζονται με τη γραμμομοριακή αναλογία, είναι δυνατόν να υπολογιστεί η συνολική μάζα της ένωσης. Αυτός ο αριθμός θα είναι ο παρονομαστής της ποσοστιαίας εξίσωσης μάζας.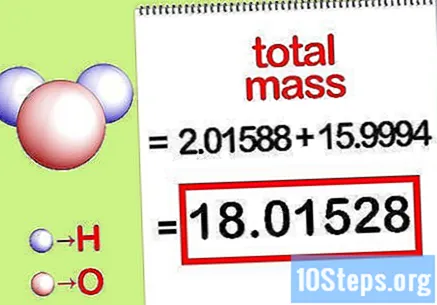
- Για παράδειγμα, προσθέστε 2,01588 g / mol (η μάζα δύο moles ατόμων υδρογόνου) με 15,9994 g / mol (η μάζα ενός μορίου ατόμου οξυγόνου) και λάβετε 18,01528 g / mol.
Προσδιορίστε τη μάζα του εν λόγω στοιχείου. Όταν πρέπει να βρείτε το ποσοστιαία μάζα, το πρόβλημα θέλει να βρείτε τη μάζα ενός συγκεκριμένου στοιχείου σε μια ένωση ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Προσδιορίστε τη μάζα του εν λόγω στοιχείου και γράψτε το. Είναι η τιμή μάζας που υπολογίζεται χρησιμοποιώντας τη μοριακή αναλογία. Αυτή η τιμή είναι ο αριθμητής της ποσοστιαίας εξίσωσης μάζας.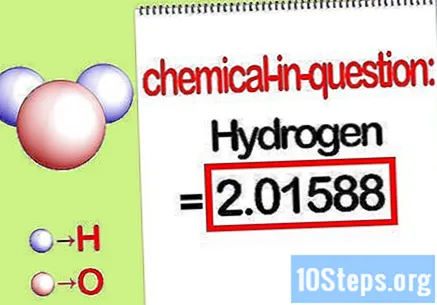
- Για παράδειγμα, η μάζα υδρογόνου της ένωσης είναι 2.01588 g / mol (η μάζα δύο moles ατόμων υδρογόνου).
- Αντικαταστήστε τις μεταβλητές στον τύπο μάζας ποσοστού. Αφού προσδιορίσετε τις τιμές για κάθε μεταβλητή, αντικαταστήστε τις στην εξίσωση που ορίζεται στο πρώτο βήμα: ποσοστό μάζας = () x 100.
- Για παράδειγμα: ποσοστό μάζας = () x 100 = () x 100.
Υπολογίστε το ποσοστό μάζας. Τώρα που έχει σχηματιστεί η εξίσωση, απλώς λύστε την για να υπολογίσετε το ποσοστό μάζας. Διαιρέστε τη μάζα του στοιχείου με τη συνολική μάζα της ένωσης και πολλαπλασιάστε επί 100. Το αποτέλεσμα θα είναι η εκατοστιαία μάζα του χημικού στοιχείου.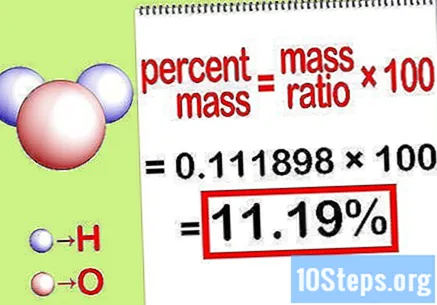
- Για παράδειγμα, ποσοστό μάζας = () x 100 = 0.111189 x 100 = 11.18%. Έτσι, η εκατοστιαία μάζα ατόμων υδρογόνου σε ένα μόριο νερού είναι 11,18%.